|
O
sal
Exploração
do sal
A
exploração de sal é uma actividade muito antiga. Desde
sempre, habituámo-nos à presença na paisagem aveirense de
montes de sal acumulado junto às salinas.

A
época da produção tinha início em Março, com a preparação
das marinhas, decorrendo a extracção desde o fim da
Primavera até Setembro/Outubro, altura em que, devido às
primeiras chuvas, era necessário cobrir os montes de sal
acumulado até esta altura.

A
extracção do sal aqui praticada é um processo experimental
artesanal. O sal é tradicionalmente transportado em mercantéis
até aos locais de armazenamento e processamento, tais como os
palheiros no canal de S. Roque, na zona antiga da cidade de
Aveiro.
Nas
últimas décadas tem-se assistido a um contínuo decréscimo
na produção, acompanhado naturalmente por uma redução no número
de salinas activas.
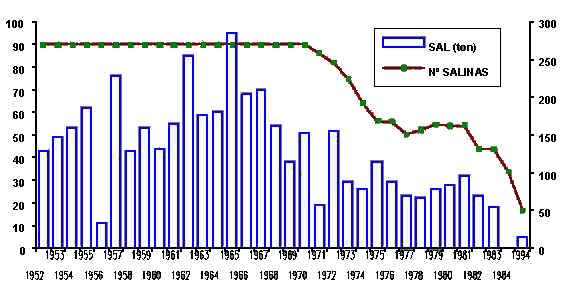
Existem
inúmeros factores que contribuem para esta redução. Entre
eles destacam-se:
- As
obras portuárias que aumentam as correntes no interior da
laguna;
- A falta
de adaptação a novas tecnologias;
- As condições
climatéricas que dificultam a concorrência com outras produções
de sal;
- O
uso generalizado de "frio" que substitui com
vantagem a conservação dos alimentos por meio de sal.
Presentemente,
cerca de 70% das salinas estão abandonadas. E dado que
economicamente deixaram de ser rentáveis, são favoravelmente
ocupadas por pisciculturas licenciadas.
O
Processo de extracção do sal
e o fenómeno da cristalização do
sal
O
processo de extracção do sal consiste essencialmente na
evaporação de soluções saturadas de cloreto de sódio
(sal), que é o principal constituinte existente nas salinas.
E por este processo separa-se o sólido da solução e
recolhe-se o conhecido «sal das cozinhas».
Existe
um processo laboratorial rápido de conseguir esta separação
que a Natureza executa duma forma mais lenta.
Este processo
designa-se por Filtração.
Estrutura
cristalina do sal
Em
quaisquer dos dois processos (laboratorial ou Natureza), o sólido
obtido é um sal cristalino que apresenta, como é evidente,
uma estrutura cristalina iónica tridimensional representada.
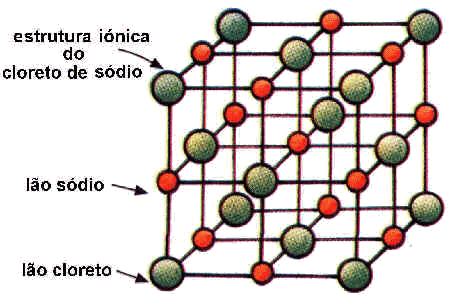
A
estrutura representada apresenta iões positivos (Na+),
a vermelho, e iões negativos (Cl--), a verde, que
se encontram unidos por ligação iónica.
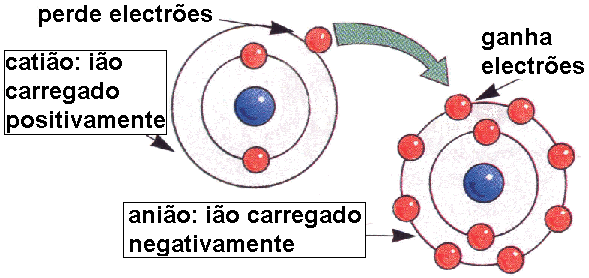
Formação
da ligação iónica
Quando
um átomo perde electrões, deixa de ser electricamente neutro
e é convertido num ião positivo (catião).
Quando
um átomo ganha electrões, deixa de ser electricamente neutro
e é convertido num ião negativo (anião).
A
ligação que se forma entre o catião e o anião é designada
ligação iónica, e por estes iões terem cargas opostas
atraem-se mutuamente. Este fenómeno é denominado de atracção
electrostática e encontra-se esquematicamente representado na
figura seguinte.
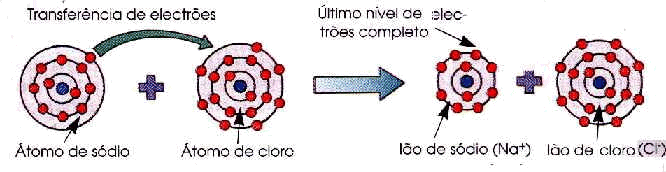
Concretizando:
Na
estrutura cristalina de cloreto de sódio (NaCl), o átomo de
sódio (Na) pode perder um electrão formando-se um ião
positivo (Na+) e o átomo de cloro (Cl) pode
aceitar esse electrão formando-se um ião negativo (Cl-).
Cada ião tem uma estrutura electrónica, em que o último nível
de electrões está completo. Conforme se
pode ver na figura seguinte, a configuração electrónica
do ião de sódio é 2:8 e a configuração electrónica do ião
de cloro é 2:8:8. Estes iões, por terem cargas opostas
atraem-se formando uma ligação iónica de que resulta a
estrutura cristalina do cloreto de sódio (NaCl), representada
anteriormente.
|