|
J. R. (3.º ciclo)
O
problema da natureza da matéria sempre preocupou o homem. Já os
gregos o debatiam. Seria a matéria divisível? Seria indivisível?
As opiniões dividem-se. Por um lado para Aristóteles e os seus
discípulos: a matéria é sempre divisível.
Por outro lado, para Leucipo e Demócrito: a matéria é
formada por partículas indivisíveis – os átomos.
Durante a Idade Média, o prestígio de Aristóteles levou ao abandono
das teorias de Demócrito. Passaram-se séculos e Dalton, baseando-se
na lei de Proust e na lei das proporções, definida por ele próprio
e enunciada, volta a afirmar: a matéria é composta por átomos. Depois, com Avogadro
–
«E os átomos juntam-se e formam moléculas.» – surge a noção de
molécula tanto para as substâncias simples, como para os compostos.
Teremos então de distinguir entre átomo e molécula.
Mas a descoberta de novos fenómenos vem revolucionar mais uma vez o
conceito do átomo. O átomo agora é divisível.
Elementos (substâncias constituídas só por uma espécie de átomos)
dão outros elementos espontaneamente: O urânio por exemplo liberta
partículas (que por sua vez se transformam em
hélio – outro elemento) e energia.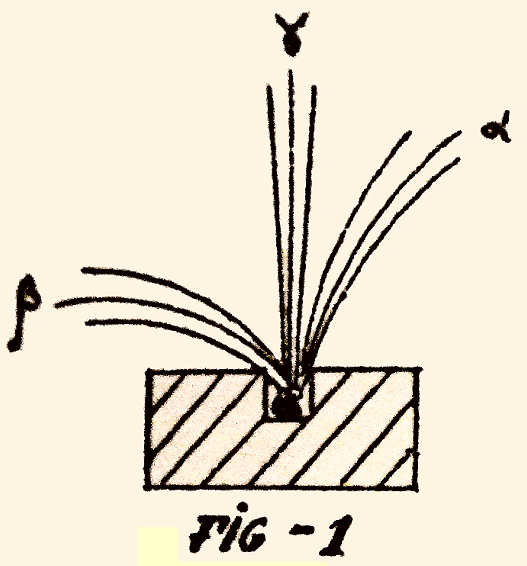
Saem dele sempre radiações. Ora viu-se que havia 3
espécies de radiações. Duas das espécies eram partículas desviadas por
um campo magnético como eléctricas (fig. 1).
O outro tipo de radiação era de natureza ondulatória como
a luz. Das primeiras radiações, tinham cinzas, cargas eléctricas
negativas (desviavam-se bastante) e umas cargas eléctricas
positivas (que se desviavam menos). Assim como numa bala se pode
medir a sua massa pelo encurvamento da trajectória (se for mais
pesada
/
22 / encurva mais a trajectória) semelhantemente se pode
determinar a massa das partículas. As partículas de carga negativa Beta, que
se chamam electrões têm uma massa pequeníssima (1/1850 da massa do
átomo de hidrogénio). As partículas altas (de carga positiva) são 4
vezes mais pesadas que um átomo de hidrogénio.
Mas se o átomo é divisível de que é formado? Fazendo incidir sobre
uma folha de alumínio muito fina, partículas α, viu-se
que passavam algumas mudando de direcção, outras, continuavam na mesma direcção.
Pelo estudo dessas trajectórias concebeu-se um modelo de átomo: O
átomo é essencialmente espaço vazio. No centro dispõem-se as cargas eléctricas positivas (protões). A circular em
volta cargas eléctricas negativas (os electrões). Actualmente
concebe-se a
parte central (núcleo) muito pesada formada por duas espécies de
partículas: neutrões e protões. Os neutrões são electricamente
neutros (sem carga eléctrica). A carga dos protões é +1. A carga dos
electrões é -1. Portanto para o átomo ser electricamente neutro,
tem de haver tantos protões como electrões.
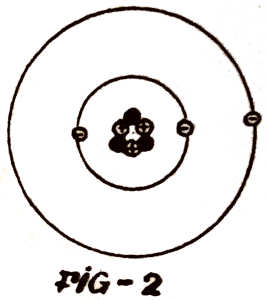 O átomo aparece assim (fig. 2) como um sistema solar em
miniatura. O sol, o núcleo. Os planetas, os electrões. Mas as
«revoluções» ainda não acabaram nem acabarão. O modelo de átomo tão
engraçado com os protões ao centro e os electrões a dançarem à volta
é muito simplificado e não permite explicar muitos fenómenos
conhecidos. Teoricamente chegou-se à conclusão que o electrão na sua
viagem, à volta do núcleo devia emitir uma
radiação (luz, por exemplo) e à medida que a emitia devia perder
energia e velocidade e por fim vinha a cair sobre o núcleo. Bohr,
grande cientista e ao mesmo tempo bom desportista (jogador de
futebol e esquiador) emitiu as seguintes hipóteses: O átomo aparece assim (fig. 2) como um sistema solar em
miniatura. O sol, o núcleo. Os planetas, os electrões. Mas as
«revoluções» ainda não acabaram nem acabarão. O modelo de átomo tão
engraçado com os protões ao centro e os electrões a dançarem à volta
é muito simplificado e não permite explicar muitos fenómenos
conhecidos. Teoricamente chegou-se à conclusão que o electrão na sua
viagem, à volta do núcleo devia emitir uma
radiação (luz, por exemplo) e à medida que a emitia devia perder
energia e velocidade e por fim vinha a cair sobre o núcleo. Bohr,
grande cientista e ao mesmo tempo bom desportista (jogador de
futebol e esquiador) emitiu as seguintes hipóteses:
1.° Num átomo, em equilíbrio os electrões não emitem radiações e as
suas órbitas são estáveis (como se verifica experimentalmente).
2.° Nem todas as órbitas calculadas pela mecânica clássica são
possíveis. A maior parte delas são interditas. Por exemplo no átomo
de hidrogénio (núcleo formado por um protão e à volta a girar um
electrão), o electrão só pode estar numa série descontínua de
órbitas (as não interditas). Só emite radiações (luz por exemplo)
quando salta duma órbita para outra interior. Absorve radiações
quando salta para uma exterior. Portanto sabendo que as radiações
correspondentes às diversas cores têm diferentes comprimentos de
onda e que também o átomo só emite ou absorve radiações quando o
electrão «salta» duma órbita para outra. Então cada átomo
(como o seu electrão só pode dar certos saltos) só pode emitir ou
absorver luz de determinados comprimentos de onda (cores). A teoria
de Bohr não ajudou a ciência a sair
/
23 /
da posição insustentável em que estava. Da mecânica clássica
deduzia-se que os átomos eram instáveis. Mas, na realidade eles eram
estáveis e as hipóteses de Bohr depois de bem desenvolvidas deram
um resultado maravilhoso. Descobrem-se então novos
fenómenos que levam à criação de uma nova teoria: a mecânica
ondulatória. O resultado mais importante a que ela chegou foi que
qualquer corpúsculo em movimento está associado a uma onda. Portanto
os electrões também; e assim deixa-se de se poder dizer duma
maneira absoluta:
Um electrão está em determinado instante em determinado ponto do
espaço. Só se pode dizer que ele tem uma certa probabilidade de aí
estar.
Entretanto foram aparecendo novas partículas. As mais
importantes são:
Positrão – partículas com as mesmas propriedades que o
electrão mas de carga positiva (encontrou-se nos raios cósmicos).
Antiprotão – partícula com a mesma massa de que o neutrão e o
protão, carregada negativamente. Será com o positrão o componente de
uma matéria nova negativa.
Mesão – grânulos de
energia de coesão internuclear.
Neutrino – sem carga eléctrica, muito pouca massa, grande
energia e grande poder de penetração. |